Химия
2.4. Характерные химические свойства оксидов: оснoвных, амфотерных, кислотных
Характерные химические свойства оксидов: основных, амфотерных, кислотных
Оксидами называются сложные вещества, которые состоят из кислорода (в степени окисления -2) и другого элемента.
Основные – это оксиды, которым соответствуют основания. К2О – КОН; ВаО – Ва(ОН)2; La2O3 – La(OH)3.
Кислотные – это оксиды, которым соответствуют кислоты. SO3 –H2SO4; CO2 – H2CO3; SO2 – H2SO3 и т.д.
Амфотерные – это оксиды, которым соответствуют амфотерные основания. ZnO – Zn(OH)2; Al2O3 – Al(OH)3.
Из основных, кислотных и амфотерных оксидов можно получать соли, поэтому их называют солеобразующими, но имеется небольшая группа оксидов, которые солей не образуют. У них нет соответствующих кислот и оснований, поэтому они называются несолеобразующими (безразличными). К ним относятся СО, N2O, NO, SiO.
Неметаллы образуют кислотные и несолеобразующие оксиды, а металлы, в зависимости от степени их окисления, могут образовывать и основные, и амфотерные, и кислотные оксиды.
Если степень окисления металла +1 и +2, то оксиды обладают основными свойствами, за исключением ZnO, BeO, SnO, PbO. Слабыми амфотерными свойствами обладают Ag2O и Cu2O.
Если степень окисления металла +3 и +4, то оксиды обладают амфотерными свойствами, за исключением La2O3, Bi2O3, Tl2O3, которые обладают основными свойствами. При степени окисления металла больше +4 оксиды являются кислотными.
Химические свойства оксидов определяются их взаимодействием с водой, кислотами и основаниями.
1. Основные оксиды наиболее активных металлов (щелочных и щелочно-земельных) взаимодействуют с водой с образованием сильных оснований – щелочей.
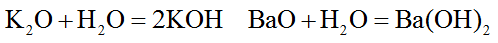
Основные оксиды менее активных металлов с водой при обычных условиях не взаимодействуют.
Все основные оксиды взаимодействуют с кислотами с образованием соли и воды.
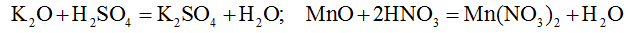
С основаниями основные оксиды не взаимодействуют.
2. Многие кислотные оксиды взаимодействуют с водой с образованием кислот:
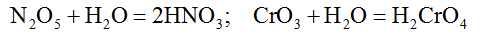
Некоторые кислотные оксиды при обычных условиях с водой не взаимодействуют.
Все кислотные оксиды взаимодействуют с основаниями с образованием соли и воды.
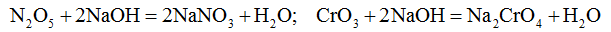
С кислотами кислотные оксиды не взаимодействуют.
3. Основные и кислотные оксиды взаимодействуют между собой с образованием соли.
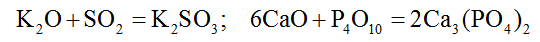
4. Амфотерные оксиды обладают и основными и кислотными свойствами, поэтому реагируют и с кислотами, и с основаниями. В этих реакциях образуются соль и вода. Амфотерный оксид Al2O3 реагирует с кислотой:
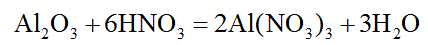
Он же взаимодействует с основаниями. При взаимодействии с расплавленными щелочами образуется алюминат натрия, а в водном растворе щелочи – комплексная соль (тетрагидроксоалюминат(III) натрия).

5. Амфотерные оксиды взаимодействуют с кислотными и основными оксидами, а также между собой. Обычно эти реакции идут при нагревании с образованием солей.
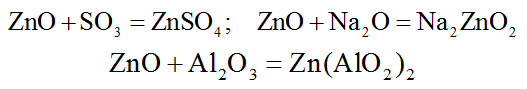
Другие материалы по данной теме
Видео
№ 45. Неорганическая химия. Тема 6. Неорганические соединения. Часть 4. Свойства основных оксидов