Химия
4.3.7. Нахождение молекулярной формулы вещества
Задачи на определение молекулярной формулы вещества
Задача 1
При сжигании 12 г органического соединения образовалось 14,4 г воды и углекислый газ, при пропускании которого через раствор гидроксида кальция образовалось 60 г осадка. Определите молекулярную формулу исходного соединения, если относительная плотность его паров по воздуху равна 2,069.
Решение:
1) Определим массу водорода в исходном органическом веществе.
Из М(Н2О) имеем: в 18 г Н2О – 2 г водорода
в 14,4 г Н2О – х г водорода
х = (14,4 · 2) / 18 = 1,6 (г) – водорода в исходном веществе.
2) Запишем уравнение реакции углекислого газа с гидроксидом кальция и определим массу углерода в исходном органическом веществе.
Сa(OH)2 + CO2 = CaCO3↓ + H2О
Из М(CaCO3) имеем: в 100 г CaCO3 – 12 г углерода
60 г CaCO3 – х г углерода
х = (60 · 12) / 100 = 7,2 (г) – углерода в исходном веществе.
3) Сделаем вывод о составе исходного органического вещества и определим его молекулярную формулу.
Так как масса органического соединения (12 г) больше, чем сумма масс углерода и водорода (7,2 + 1,6 = 8,8 г), то это соединение, судя по продуктам горения содержит 12 – 8,8 = 3,2 г кислорода и его формула может быть записана как СxНyОz, где х, у, z – количество атомов углерода, водорода, кислорода соответственно.
х : у : z = 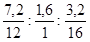 = 0,6 : 1,6 : 0,2 = 3 : 8 : 1;
= 0,6 : 1,6 : 0,2 = 3 : 8 : 1;
Простейшая формула С3Н8О. М(С3Н8О) = 3·12 + 8 + 16 = 60 г/моль.
4) Молярная масса вещества М(СxНyОz) = 29 · DВ = 29 · 2,069 = 60 г/моль.
Совпадение молярных масс указывает, что истинная формула – С3Н8О.
Ответ: Молекулярная формула исходного соединения С3Н8О.
Задача 2
При сжигании вещества массой 10,7 г получили 30,8 г углекислого газа, 8,1 г воды и 1,4 г азота. Плотность паров этого вещества по воздуху равна 3,69. Определите молекулярную формулу вещества.
Решение:
1) Рассчитаем кол-ва веществ и массы углерода, водорода и азота в исходном веществе:
n(C) = n(CO2) = m(CO2) : M(CO2) = 30,8 : 44 = 0,7 (моль);
m(C) = M(C) · n(C) = 12 · 0,7 = 8,4 (г) – углерода в исходном веществе;
n(Н) = 2n(Н2О) = 2 · 8,1 : 18 = 0,9 (моль);
m(Н) = 0,9 (г) – водорода в исходном веществе;
n(N) = 2n(N2) = 2 · 1,4 : 28 = 0,1 (моль);
m(N) = 14 · 0,1 = 1,4 (г) – азота в исходном веществе;
2) Так как масса исходного соединения (10,7 г) равна сумме масс углерода, водорода и азота (8,4 + 0,9 + 1,4 = 10,7 г), то это соединение, судя по продуктам горения, не содержит кислород и его формула может быть записана как СxНyNz, где х, у, z – количество атомов углерода, водорода, азота соответственно.
х : у : z = 0,7 : 0,9 : 0,1 = 7 : 9 : 1;
Простейшая формула С7Н9N. М(С7Н9N) = 7·12 + 9 + 14 = 107 г/моль.
3) Молярная масса вещества М(СxНyNz) = 29 · DВ = 29 · 3,69 = 107 г/моль.
Совпадение молярных масс указывает, что истинная формула – С7Н9N.
Ответ: Молекулярная формула исходного вещества С7Н9N.
Другие материалы по данной теме
Видео
Нахождение молекулярной формулы вещества
