Физика
2.1. МОЛЕКУЛЯРНАЯ ФИЗИКА
Физический смысл универсальной газовой постоянной
Величины, характеризующие состояние газа, это m – масса газа,
V – объём газа, P – давление газа, T – температура газа. Эти величины называются параметрами состояния. Уравнение, связывающее параметры m, Р, V и T, называется уравнением состояния.
Уравнение состояния идеального газа – это уравнение Менделеева – Клапейрона
\(PV = \frac{m}{{\rm{\mu }}}RT\), (9.8)
где m – масса газа; m – масса одного моля газа, тогда 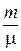 – число молей газа. Для одного моля газа
– число молей газа. Для одного моля газа 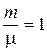 уравнение Менделеева – Клапейрона записывается:
уравнение Менделеева – Клапейрона записывается:
\(PV = RT\), (9.9)
где R – универсальная газовая постоянная.
Выясним физический смысл универсальной газовой постоянной R.
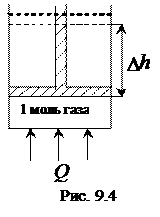 Пусть 1 моль идеального газа заключен в цилиндр под поршень (рис. 9.4). Первое, начальное, состояние газа характеризуется параметрами V1, Р1, T1. Будем нагревать газ при постоянном давлении (P1 = const).
Пусть 1 моль идеального газа заключен в цилиндр под поршень (рис. 9.4). Первое, начальное, состояние газа характеризуется параметрами V1, Р1, T1. Будем нагревать газ при постоянном давлении (P1 = const).
Пусть второе, конечное, состояние газа характеризуется параметрами V2, Р1, T2. При подводе тепла Q поршень приподнялся на высоту Dh в результате расширения газа при постоянном давлении P1. Газ совершил работу А по поднятию поршня:
\(A = F\Delta h\), (9.10)
где F – сила, действующая на поршень со стороны газа; P1 – давление газа на поршень. Давление P1 и сила F связаны соотношением
\({P_1} = \frac{F}{S}\), (9.11)
где S – площадь поршня. Отсюда \(F = {P_1}S\) и \(A = {P_1}S\Delta h\). Но \(S\Delta h = \Delta V\), \(\Delta V\)– изменение объёма газа; \(\Delta V = {V_2} - {V_1}\). Следовательно, \(A = {P_1}\Delta V\). Найдём \(\Delta V\).
Записываем уравнение Менделеева – Клапейрона для 1 моля газа дважды: для первого состояния и для второго:
\(\left\{ \begin{array}{l}{P_1}{V_1} = R{T_1},\\{P_1}{V_2} = R{T_2},\end{array} \right.\) (9.12)
и вычтем из нижнего уравнения верхнее. Получим
\({P_1}({V_2} - {V_1}) = R({T_2} - {T_1})\) или \({P_1}\Delta V = R\Delta T\),
где \(\Delta T\)– изменение температуры при переходе газа из начального состояния в конечное состояние. Так как
\(A = {P_1}\Delta V = R\Delta T\),
то
\(R = \frac{A}{{\Delta T}}\). (9.13)
Теперь можно определить физический смысл универсальной газовой постоянной R.
Универсальная газовая постояннаяR равна работе, которую совершает 1 моль идеального газа при изобарическом расширении, если газ нагреть на один градус.
Другие материалы по данной теме
Видео
"Экспресс-подготовка к ЕГЭ" от МФТИ, Физика, Термодинамика и молекулярная физика
