Физика
Раздел: Физика / 2. МОЛЕКУЛЯРНАЯ ФИЗИКА. ТЕРМОДИНАМИКА / 2.1. МОЛЕКУЛЯРНАЯ ФИЗИКА / 2.1.10. Модель идеального газа в термодинамике / 2.1.10.1. Уравнение Менделеева- Клапейрона
Гелий и аргон можно описывать моделью идеального одноатомного газа, для которого применимо уравнение Клапейрона–Менделеева \(PV=\nu RT\). Поршень в цилиндре вначале находится в состоянии механического равновесия, так что давления газов в начальный момент совпадают. То же самое можно сказать и про конечный момент времени. В начальный момент объёмы газов одинаковы и равны 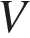 , и уравнение Клапейрона–Менделеева приводит к связи между начальными температурами гелия и аргона \(T_{1}\) и \(T_{2}\) и числом молей этих газов \(\nu _{1}\) и \(\nu _{2}\): \(\nu _{1}T_{1}=\nu _{2}T_{2}\).
, и уравнение Клапейрона–Менделеева приводит к связи между начальными температурами гелия и аргона \(T_{1}\) и \(T_{2}\) и числом молей этих газов \(\nu _{1}\) и \(\nu _{2}\): \(\nu _{1}T_{1}=\nu _{2}T_{2}\).
После установления теплового равновесия температура газов равна \(T\), а объёмы гелия и аргона изменились и стали равны \(V_{1}\) и \(V_{2}\) соответственно. Уравнения Клапейрона–Менделеева, записанные для состояний газов в этот момент, приводят к соотношению \(\frac{V_{1}}{V_{2}}=\frac{\nu _{1}}{\nu _{2}}\). Поскольку суммарный объём цилиндра остался неизменным, можно записать: \(V_{1}+V_{2}=2V\). Тогда получаем, что \(\frac{V_{1}}{V}=\frac{2}{1+\frac{\nu _{2}}{\nu _{1}}}\). Учитывая, что \(\frac{\nu _{2}}{\nu _{1}}=\frac{T _{1}}{T _{2}}\) , получим \(\frac{V_{1}}{V}=2\frac{T_{2}}{T_{1}+T_{2}}=\frac{3}{2}=1,5\).
