Химия
1.1.1. Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атома. Основное и возбужденное состояние атомов
Современные положения теории строения атома
Последовательность расположения атомных орбиталей по мере увеличения энергии электрона в многоэлектронном атоме.
1s2s2p3s3p4s3d4p5s4d5p6s4f5d6p7s5f6d7p
Рисунок, иллюстрирующий правило Клечковского.
Легко запомнить порядок расположения подуровней, если использовать «правило стрелки»
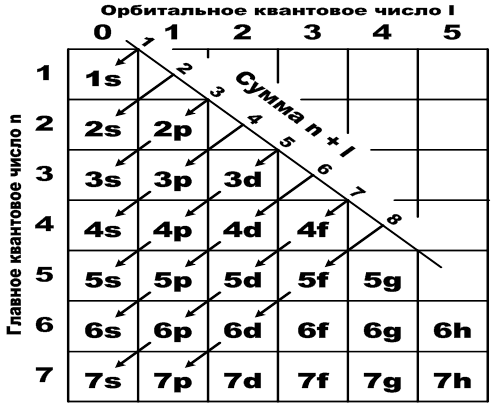
6. Атомной орбиталью (АО) называется совокупность положений электрона в атоме, характеризуемых определенными значениями квантовых чисел n, l, m. Есть и другие определения атомной орбитали. Например, атомной орбиталью называется область пространства, где электрон находится с вероятностью 95%.
У каждого атома имеется бесконечный набор атомных орбиталей, которые заполняются электронами по правилам.
а). Принцип наименьшей энергии.
Он отражает стремление любого атома находиться в основном (невозбужденном) состоянии. На практике заполнение по этому принципу определяется 1 и 2 правилами Клечковского.
б). Принцип Паули (в рамках "а").
На каждой орбитали может быть максимум 2 электрона с противоположными спинами.
в). Правило Гунда.
При заполнении p, d, f – подуровней, если на них больше одного электрона, то они заполняются так, чтобы суммарный спин был максимальный.
г). Наиболее устойчивые электронные конфигурации – пустые s0, p0, d0, f0; полностью заполненные s2, p6, d10, f14 и наполовину заполненные p3, d5, f7.
Cr24 1s22s22p63s23p64s23d4 Cr24 1s22s22p63s23p64s13d5
Для атома хрома электроно-графическая формула выглядит так:
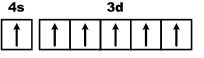
Это явление называется проскок (провал) электрона. Если Вам попадется такой вопрос, то пользуйтесь периодической системой Менделеева, т.к. проскок электрона определяется экспериментально. Например, у хрома (4s13d5) и молибдена (5s14d5) есть проскок электрона, а у их аналога вольфрама нет (6s25d4).
Валентные электроны – электроны, обладающие наибольшей энергией, электроны последних уровней. Они имеют большое значение при образовании химической связи.
| Семейство элементов | Электронная формула валентных электронов |
| s-элементы | ns n – внешний слой, имеющий максимальное значение n. |
| p-элементы | ns и np |
| d-элементы | ns и (n-1)d |
Другие материалы по данной теме
Видео
Строение электронных оболочек. Схема строения атома
Определение
Дальтониды
