Химия
1.2.4. Общая характеристика неметаллов IVА–VIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов
Электроотрицательность неметаллов
Для неметаллов характерны высокие значения электроотрицательности, она изменяется в пределах от 2 до 4. неметаллы – это элементы главных подгрупп, преимущественно p-элементы, исключение составляет водород – s-элемент.
У атомов неметаллов преобладают окислительные свойства, то есть способность присоединять электроны. В соответствии с численными значениями относительных электроотрицательностей окислительные способности неметаллов увеличиваются в следующем порядке:
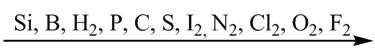
Все неметаллы, кроме фтора, проявляют восстановительные свойства (способность отдавать электроны). Причем эти свойства постепенно возрастают от кислорода к кремнию:
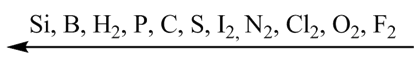
Химические свойства.
1. Окислительные свойства неметаллов
- взаимодействие с металлами:
2Na + S = Na2S
- взаимодействие с водородом (образуются летучие водородные соединения):
H2 + Cl2 = 2HCl
- любой неметалл выступает в роли окислителя в реакциях с теми неметалами, которые имеют более низкое значение электроотрицательности:
2P + 3Cl2 = 2PCl3
- взаимодействие со сложными веществами:
CH4 + 2O2 = CO2 + 2H2O
2. Восстановительные свойства
- взаимодействие с кислородом (исключение – фтор):
4P + 5O2 = P4O10
- взаимодействие со сложными веществами-окислителями:
S + 6HNO3 = H2SO4 + 6NO2# + 2H2O.
При взаимодействии с неметаллами концентрированная серная кислота восстанавливается до SO2.
3. Реакция диспропорционирования
Она характерна для активных неметаллов. Протекает в щелочной среде:
3I2 + 6NaOH = 5NaI + NaIO3 + 3H2O.
Другие материалы по данной теме
Видео
№ 190. Неорганическая химия. Тема 22. Неметаллы и водород. Часть 1. Свойства неметаллов
