Химия
1.1.1. Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атома. Основное и возбужденное состояние атомов
Рейтинг: 0
Современные положения теории строения атома
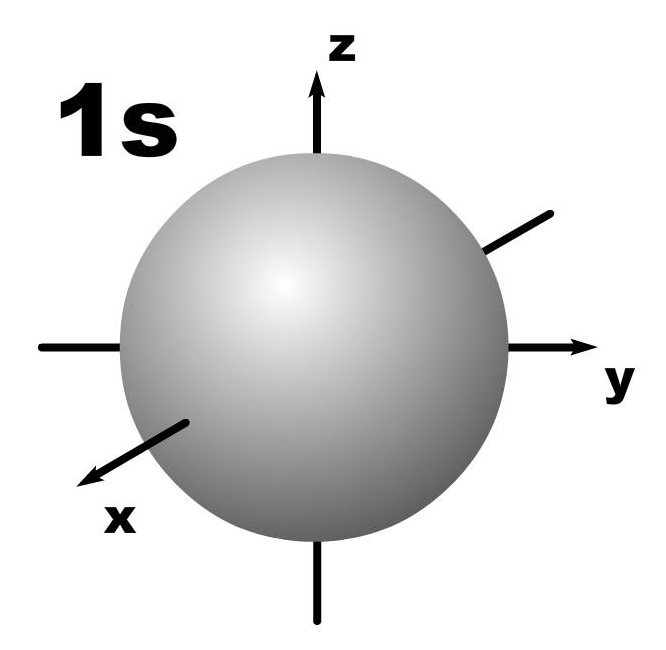
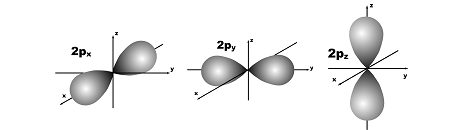
l=1; гантель, m=+1,0,-1; три орбитали по осям Х, У, Z.
l=2; m=+2,+1,0,-1,-2; пять орбиталей.
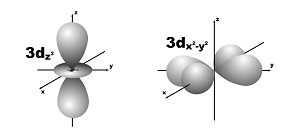
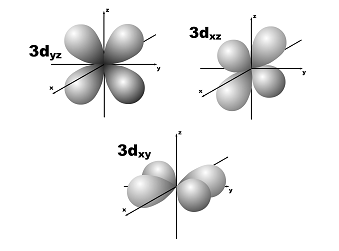
5. Энергия электрона в многоэлектронном атоме.
Решая уравнение Шредингера, получаем, что:
а) чем больше n+l, тем > энергия электрона в атоме – первое правило Клечковского;
б) если сумма n+l одинакова, то предпочтение отдается главному квантовому числу n. Чем больше n, тем больше энергия электрона в атоме – второе правило Клечковского.
Время на изучение: 30 минут
Другие материалы по данной теме
Видео
1.3. Современная теория строения атома - квантовая механика
Определение
Бертоллиды
