Химия
1.4.9. Электролиз расплавов и растворов (солей, щелочей, кислот)
Закономерности анодного окисления
Характер реакций, протекающих на аноде, зависит как от присутствия молекул воды, так и от вещества, из которого сделан анод. Нерастворимые аноды (графит, платина) при электролизе сами не посылают электроны во внешнюю цепь, электроны посылаются в результате окисления анионов и молекул воды.
На аноде протекают реакции окисления восстановителей, поэтому в первую очередь на аноде должны реагировать наиболее сильные восстановители (имеющие меньший электродный потенциал).
1. На аноде разряжаются простые анионы (Cl‑, Br‑, I‑, S2-), кроме F‑.
Анод: 2Cl‑ ‑ 2e = Cl2
2. Сложные анионы и F‑ сами не разряжаются, а происходит анодное окисление воды:
Анод: 2Н2О – 4е = О2 + 4Н+
3. Если анод растворимый, то конкурируют три процесса:
а) Ме – ne = Men+ ‑ растворение (окисление) металла;
б) 2Н2О – 4е = О2 + 4Н+ окисление воды j°=1,23 В;
в) Окисление анионов.
Наименьшим потенциалом обладает окисление металла, поэтому на аноде будет происходить именно этот процесс.
В случае электролиза CuCl2 с растворимым медным анодом будут происходить следующие процессы:
на аноде: Cu – 2e = Cu2+
на катоде: Cu2+ + 2e = Cu
Суммарная реакция 0=0, т.е. просто происходит перенос меди с анода на катод. Этот процесс называется рафинированием (очисткой) меди.
При электролизе расплавов воды нет, и будут разряжаться сами катионы и анионы.
Примеры
1. Электролиз СuSO4 \(\leftrightarrow\) Cur2+ + SO42-
Медь – металл неактивный (φо= +0,34 В), поэтому на катоде идет только: разрядка катиона, а на аноде разрядка воды, т.к. анион SO42- сложный.
на катоде (-): Cu2+ + 2е \(\to\) Cu;
Cu2+ и Н2О
на аноде (+): 2Н2О - 4е \(\to\) О2 + 4Н+
SO42- и Н2О
Схема электролиза:
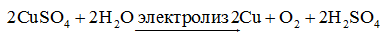
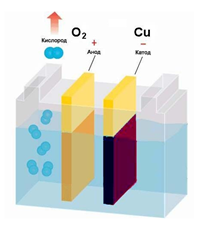
Для СuSO4 на аноде выделяется кислород, а на катоде медь.
2. Электролиз HCl
Н+ можно отнести к неактивным, поэтому на катоде идет разрядка катиона, а на аноде идет разрядка хлорид иона, т.к. анион простой.
На катоде: 2Н+ + 2е \(\to\)" Н2
Н+ и Н2О
На аноде: 2Cl- - 2e \(\to\) Cl2
Cl- и Н2О
Схема электролиза
2HCl " Н2 + Cl2
3. Электролиз NaOH
Натрий – активный металл (φо= -2,71 В), поэтому на катоде идет только разрядка вода, а на аноде тоже разрядка воды, т.к. анион ОН- сложный.
на катоде (-): 2Н2О + 2е \(\to\) Н2 + 2ОН-
Na+ и Н2О
на аноде (+): 2Н2О - 4е \(\to\) О2 + 4Н+
OH- и Н2О
Схема электролиза
2Н2О " 2Н2 + О2
При электролизе гидроксида натрия на катоде выделяется в 2 раза больше газа (водорода), чем на аноде (кислорода).
Другие материалы по данной теме
Видео
7.4. Электролиз водного раствора сульфата натрия
Определение
Электролиз

