Химия
1.4.9. Электролиз расплавов и растворов (солей, щелочей, кислот)
Электролиз расплавов и растворов
Электролизом называется несамопроизвольная химическая реакция, протекающая при пропускании постоянного тока через раствор или расплав электролита.
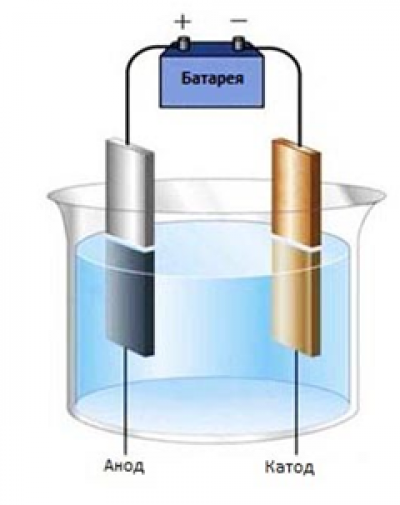
Простейшая установка для проведения реакции электролиза. Через раствор электролита пропускается постоянный электрический ток.
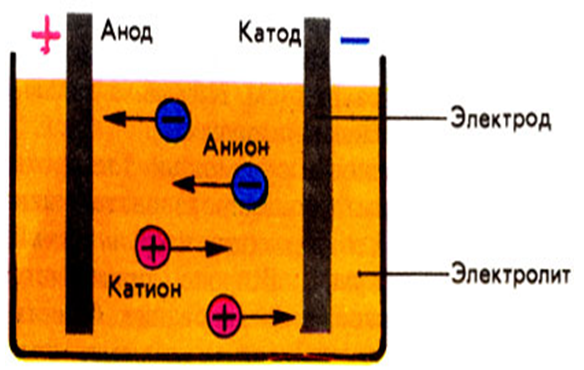
К катоду (-) движутся катионы, а к аноду (+) – анионы
Закономерности катодного восстановления
Так как на катоде идет реакция восстановления, то в первую очередь должны реагировать наиболее сильные окислители, т.е. имеющие наиболее положительный электродный потенциал.
Для катодного восстановления при электролизе водного раствора электролита все окислители можно разделить на три группы.
1. Если соль содержит катион активного металла, электродный потенциал которых существенно более отрицателен, чем потенциал водородного электрода (в ряду напряжений до Аl). В водных растворах разряд этих ионов практически не происходит, так как на катоде происходит разложение только воды.
Kатод: 2H2O + 2e = H2 + 2OH‑
2. Если соль образована катионом неактивного металла (в ряду напряжений за водородом), то на катоде выделяется сам металл, а разряд катионов водорода не происходит.
Катод: Cu2+ + 2e = Cu
3. Если соль образована катионом металла, электродный потенциал которого мало отличается от водородного (они стоят в ряду напряжения между алюминием и водородом), то идут оба процесса, которые в сильной степени зависят от условий электролиз (плотности тока и т.д.). На катоде в этом случае мы будем писать оба процесса: и разложение воды, и выделение металла.
Kатод: 2H2O + 2e = H2 + 2OH‑
Ni2+ +2e=Ni
Кроме того, выделение водорода на многих катодах идет с более высоким перенапряжением, чем перенапряжение разряда многих металлов. Так, например, для солей цинка сначала выделяется водород, а при больших плотностях тока только цинк.
В данном случае высокое водородное перенапряжение – явление положительное, т.к. из водных растворов удается выделить многие металлы, которые более активны, чем водород.
Другие материалы по данной теме
Видео
7.2. Закономерности катодного восстановления
Определение
Электролиз