Химия
3.7. Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот
Амины как органические основания
Амины – это органические производные аммиака, в которых один или несколько атомов водорода замещены углеводородными радикалами. Общие формулы аминов: первичные амины RNH2, вторичные амины R2NH, третичные амины R3N, где R – алкильная или арильная группа.
Основность аминов. Образование солей с кислотами
Основность – способность молекулы или иона присоединять протон. Следовательно, основания – это молекулы или ионы, присоединяющие протон во время реакции. С точки зрения электронной теории основания – это соединения, предоставляющие пару электронов для образования ковалентной связи.
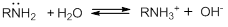
Амины, как и аммиак, проявляют свойства оснований из-за наличия свободной электронной пары на атоме азота. Алифатические амины являются довольно сильными основаниями, их водные растворы имеют щелочную реакцию:
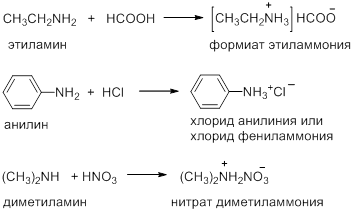
Амины реагируют с органическими и неорганическими кислотами, образуя соли:
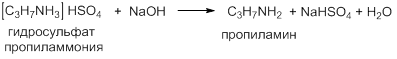
Соли аминов превращаются в амины при обработке их растворами щелочей, являющихся более сильными основаниями:
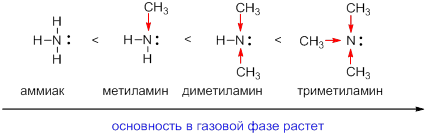
Зависимость основности от строения аминов
Основность аминов зависит от природы и числа заместителей, связанных с атомом азота. Алифатические амины – более сильные основания, чем аммиак, благодаря положительному индукционному (индуктивному) эффекту алкильных групп (на схеме красными стрелками показано смещение электронной плотности в сторону более электроотрицательного атомаазота). Индуктивный эффект увеличивает электронную плотность на атоме азота и способность амина связывать протон возрастает. Чем больше алкильных групп, тем выше электронная плотность на атоме азота:
Следует отметить, что третичные амины могут проявлять меньшую основность, чем вторичные в водных средах, что связано с сольватацией образовавшегося катиона молекулами воды.
Ароматические амины являются более слабыми основаниями по сравнению с алифатическими аминами, что можно объяснить взаимодействием неподеленной пары электронов азота с электронами ароматического кольца – их сопряжением или мезомерным эффектом (сопряжение показано изогнутой стрелкой):
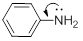
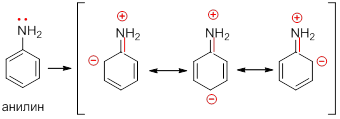
Такое сопряжение понижает способность неподеленной пары электронов присоединять протон. Эффект сопряжения можно изобразить набором резонансных структур, из которого видно, что электронная плотность понижается на атоме азота и увеличивается на бензольном кольце:
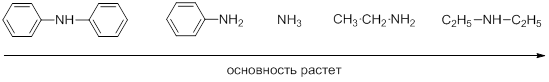
Таким образом, основность аммиака, алифатических и ароматических аминов изменяются в ряду:
Другие материалы по данной теме
Видео
№ 170. Органическая химия. Тема 26. Аминокислоты. Часть 6. Схема химических свойств аминокислот