Физика
3.2.10.1. Механизмы проводимости твёрдых металлов, растворов и расплавов электролитов, газов
Электрический ток в электролитах
Электролитами принято называть проводящие среды, в которых протекание электрического тока сопровождается переносом вещества. Носителями свободных зарядов в электролитах являются положительно и отрицательно заряженные ионы.
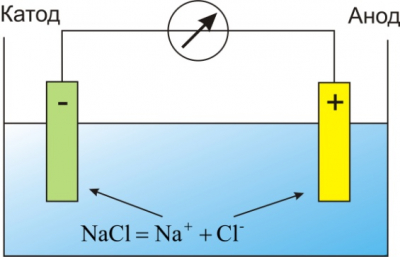
Основными представителями электролитов, широко используемыми в технике, являются водные растворы неорганических кислот, солей и оснований. Прохождение электрического тока через электролит сопровождается выделением веществ на электродах. Это явление получило название электролиза (рис.).
Электрический ток в электролитах представляет собой перемещение ионов обоих знаков в противоположных направлениях. Положительные ионы движутся к отрицательному электроду (катоду), отрицательные ионы – к положительному электроду (аноду). Ионы обоих знаков появляются в водных растворах солей, кислот и щелочей в результате расщепления части нейтральных молекул. Это явление называется электролитической диссоциацией.
Закон электролиза был экспериментально установлен английским физиком М. Фарадеем в 1833 году.
Первый закон Фарадея определяет количества первичных продуктов, выделяющихся на электродах при электролизе: масса m вещества, выделившегося на электроде, прямо пропорциональна заряду q, прошедшему через электролит:
m = kq = kIt,
где k – электрохимический эквивалент вещества:
\(k = \frac{1}{F}\frac{\mu }{n}\)
F = eNA = 96485 Кл / моль. – постоянная Фарадея.
Второй закон Фарадея электрохимические эквиваленты различных веществ относятся их химические эквиваленты\({k_x}\):
\(\frac{{{k_2}}}{{{k_1}}} = \frac{{{k_{x2}}}}{{{k_{x1}}}}\).
Объединенный закон Фарадея для электролиза:
\(m = \frac{1}{F}\frac{\mu }{n}It\).
Электролитические процессы классифицируются следующим образом:
- получение неорганических веществ (водорода, кислорода, хлора, щелочей и т.д.);
- получение металлов (литий, натрий, калий, бериллий, магний, цинк, алюминий, медь и т.д.);
- очистка металлов (медь, серебро,…);
- получение металлических сплавов;
- получение гальванических покрытий;
- обработка поверхностей металлов (азотирование, борирование, электрополировка, очистка);
- получение органических веществ;
- электродиализ и обессоливание воды;
- нанесение пленок при помощи электрофореза.
Другие материалы по данной теме
Определение
Второй закон электролиза (второй закон Фарадея)