Химия
1.4.8. Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее
Коррозия металлов и способы защиты от нее.
Самопроизвольно протекающий процесс разрушения металлов в результате взаимодействия с окружающей средой называется коррозией. Металлы окисляются и образуются продукты коррозии, состав которых зависит от ее условий.
Меры борьбы с коррозионными процессами являются актуальной задачей современной техники.
Наиболее актуальна защита от электрохимической коррозии металла в средах, имеющих ионную проводимость, протекает через анодное окисление металла
Ме – nе \(\to\) Men+
и катодное восстановление окислителя.
Наиболее часто при коррозии окислителями являются:
1) кислород и протекает кислородная коррозия
О2 + 2Н2О + 4е = 4ОН–;
2) ион водорода в кислой среде и протекает водородная коррозия
2Н+ + 2е = Н2
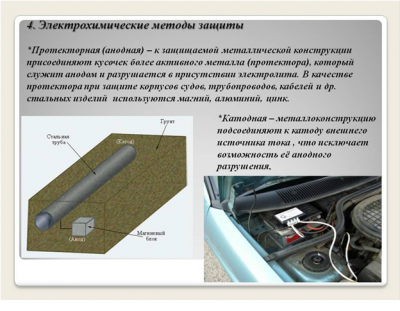
Защита металлов от коррозии
1. Создание рациональных конструкций, способствующее предотвращению коррозии. Необходимо, чтобы при выпадении осадков не происходило скапливание атмосферной воды на агрегатах и приборах, что приводит к «точечной» коррозии. Очень важна также термическая обработка изделий, подвергающихся различным деформациям, чтобы избежать «ножевой» коррозии.
2. Изменение свойств коррозионной среды.
Для снижения агрессивности среды уменьшают концентрацию компонентов, опасных в коррозионном отношении.
Например, удаление кислорода из воды кипячением. Восстановление окислителей сульфитами, гидразином и др.. Удаляют галогены, так как они чаще всего ускоряют коррозию.
Вводят ингибиторы, при добавлении которых резко уменьшается скорость коррозии по разным причинам.
Легирование (пассивация) металлов – эффективный, но дорогой метод повышения коррозионной стойкости металлов. В качестве компонентов, вызывающих пассивацию металлов применяют хром, никель вольфрам и некоторые другие металлы.
3. Защитные покрытия.
Защитными покрытиями являются искусственно создаваемые слои на поверхности металлов, предохраняющие их от коррозии.
Различают катодные и анодные покрытия.
В качестве катодного покрытия используют неактивный металл (золото и др.), электродный потенциал металла-покрытия больше чем у защищаемого металла.
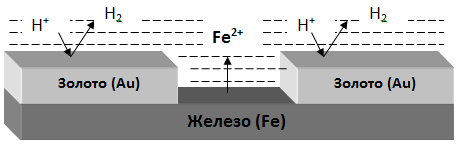
Рис. Процессы, проходящие при разрушении катодного покрытия защищаемого металла.
При разрушении покрытия образуется коррозионный гальванический элемент. Металл покрытия является катодом, а защищаемый металл – анодом.
В качестве анодного покрытия используются металлы, электродный потенциал которых меньше, чем у защищаемого металла, но эти металлы в природных условиях покрыты прочной оксидной пленкой, которая защищает их от разрушения под действием окружающей среды (цинк, хром и другие металлы).
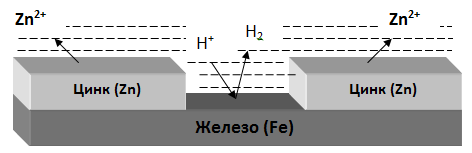
Рис. Процессы, проходящие при разрушении анодного покрытия защищаемого металла.
При разрушении покрытия образуется коррозионный гальванический элемент. Металл покрытия является анодом, а защищаемый металл – катодом.
Для получения металлических и неметаллических защитных покрытий существуют различные способы их нанесения.
А. Металлизация.
Б. Термодиффузия.
В. Химические способы (лакирование, окраска, покрытие полимерами, оксидирование, фосфатирование и другие).
Г. Электрохимические методы (гальванические покрытия).
«Метод внешнего потенциала».
В этом методе защищаемое изделие подключается к отрицательному полюсу внешнего источника постоянного тока, поэтому оно становится катодом, а в качестве анода обычно стальной электрод, который заземляется.
Этот метод используется, если нет контакта с человеком или животными.
Другие материалы по данной теме
Определение
Коррозия
Видео
Химия. Окислительно-восстановительные реакции №1