Химия
3.2. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа
Гибридизация sp-типа. Третье валентное состояние атома углерода. Строение молекулы ацетилена
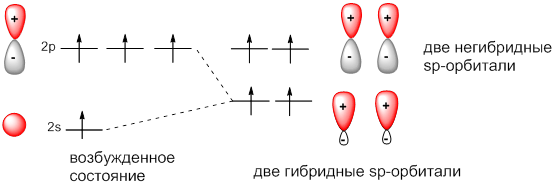
sр-Гибридизация: взаимодействуют, выравниваясь по форме и энергии только две орбитали атома углерода: одна σ- и одна π. Образуются две новых sр-орбитали и остаются две негибридных p-орбитали:
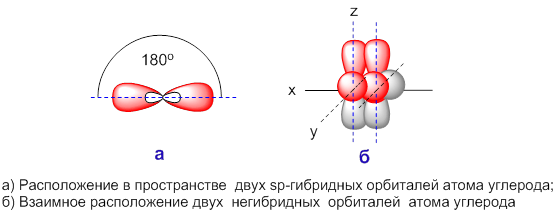
Гибридные орбитали лежат на одной прямой, угол между их осями равен 180о, оси двух негибридизованных р-орбиталей взаимно перпендикулярны и перпендикулярны осям sp-орбиталей. При перекрывании одной sp‑орбитали и двух негибридных p-орбиталей с орбиталями другого атома образуется тройная связь.
Электронное строение молекулы ацетилена определяет её пространственное строение. Центры всех четырёх атомов лежат на одной прямой, плоскости в которых расположены электронные плотности π-связей взаимно перпендикулярны. Тройная связь содержит одну σ-связь и две π-связи.
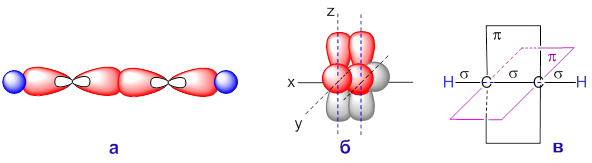
На рисунке показано образование σ-связей (а) и π-связей (б) в молекуле ацетилена, а также взаимное расположение плоскостей π-связей (в).
Модель молекулы ацетилена
Итак, гибридные орбитали атома углерода способны участвовать в образовании только σ-связей, незатронутые гибридизацией р-орбитали образуют только π-связи. Именно этой особенностью определяется пространственное строение молекул органических веществ.
Другие материалы по данной теме
Видео
Гибридизация урок
