Химия
3.2. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа
Химические связи в молекулах органических соединений
Химическая связь – это силы взаимодействия между атомами или группами атомов, приводящие к образованию молекул, ионов, и т.д. По своей природе химическая связь – это электростатические силы. Главную роль при образовании химической связи между атомами играют их валентные электроны, т. е. электроны внешнего уровня, наименее прочно связанные с ядром. Из курса общей химии вы знаете о существовании ковалентной и ионной связи.
Ионная связь – это химическая связь, основанная на электростатическом притяжении ионов. Она возникает при большой разнице электроотрицательностей связываемых атомов. В органических соединениях ионные связи встречаются довольно редко, например, в солях карбоновых кислот:
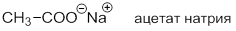
Для органических соединений наиболее характерна ковалентная связь.
Ковалентная связь – это химическая связь, образованная за счет обобществления электронов двумя и более ядрами. Существуют два способа обобществления электронной пары: обменный и донорно-акцепторный.
По обменному механизму в образовании связи участвуют по одному электрону от каждого атома:
Н· + Cl· → H : Сl
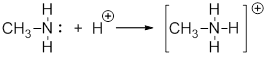
По донорно-акцепторному механизму ковалентная связь образуется за счет объединения электронной пары одного атома и свободной орбитали другого. Примером может служить взаимодействие молекулы амина с протоном с образованием метиламмоний катиона:
Классификация ковалентной связи по способам перекрывания атомных орбиталей
В зависимости от способа перекрывания атомных орбиталей различают σ- и π-связи. σ –связи образуются в результате перекрывания орбиталей вдоль линии, соединяющей центры ядер двух атомов:
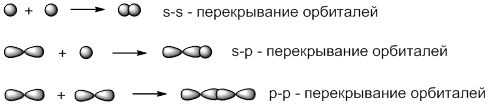
π –связи образуются в результате бокового p-p-перекрывания орбиталей, в результате которого образуются две области повышенной электронной плотности:

Типы разрыва ковалентной связи
Разрыв ковалентной связи может происходить по гомолитическому или гетеролитическому механизмам.
Гомолитические реакции – реакции, в которых разрыв связи происходит симметрично, так что каждому из образующихся фрагментов отходит по одному электрону:
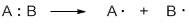
Гомолиз от греческого homos – одинаковый, lysis – разрыв.
В ходе гомолитических реакций в качестве интермедиатов образуются свободные радикалы – частицы, содержащие неспаренный электрон, например:
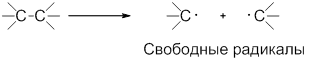
Радикал – атом или группа атомов, имеющие неспаренный электрон.
Гетеролитические реакции – реакции, в которых разрыв связи происходит несимметрично, так что пара электронов связи остается у одного из образующихся фрагментов:

Гетеролиз – это несимметричный разрыв ковалентной связи, в результате которого образуются разные по природе частицы: катион и анион.
Если заряды в таких частицах находятся на атоме углерода, их называют – карбокатионы и карбанионы, например:

Электронная пара остается у более электроотрицательного атома.
Другие материалы по данной теме
Видео
Гибридизация урок
