Химия
3.2. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа
Гибридизация sp2-типа. Второе валентное состояние атома углерода. Строение молекулы этилена
sр2-Гибридизация – это тип гибридизации, при котором выравниваются по энергиям одна s-орбиталь и две p-орбитали.
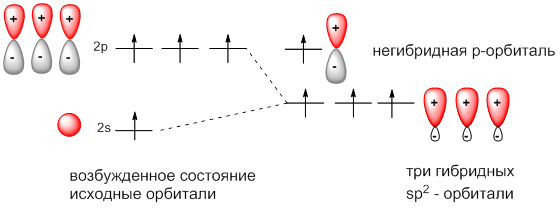
Три гибридные sp2-орбитали расположены в одной плоскости и максимально удалены друг от друга (направлены к вершинам треугольника, угол между ними составляет 120°). Оставшаяся негибридная p-орбиталь расположена в плоскости, перпендикулярной плоскости гибридных орбиталей:
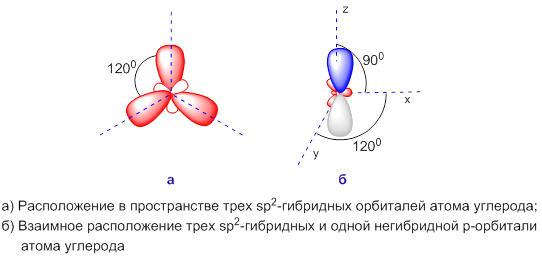
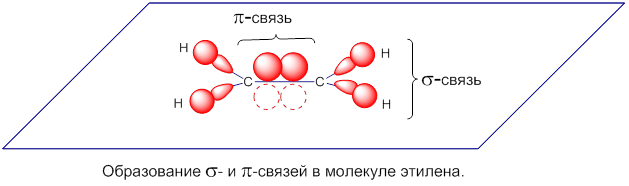
Атом, находящийся в состоянии sp2-гибридизации способен образовывать двойную связь с другим атомом (Y=Х). Одна связь – σ-связь (образована гибридной sp2-орбиталью), вторая связь – π-связь образуется при перекрывании негибридных p-орбиталей
Другие материалы по данной теме
Видео
Гибридизация урок
