Химия
3.4. Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и толуола)
Окисление алкенов
Термин «окисление» в применении к двойным связям обычно ограничен реакциями, в которых разрывается либо π-связь (мягкое окисление), либо π- и σ-связь (жесткое окисление), при этом образуются новые связи с кислородом. Глубокое окисление может разрушить также и связи ═С─Н.
Возможные продукты окисления алкенов - эпоксиды, вицинальные диолы, альдегиды, кетоны, карбоновые кислоты и диоксид углерода.
Рассмотрим некоторые реакции окисления:
Эпоксидирование
Эпоксиды образуются при окислении олефинов кислородом воздуха в присутствии серебряного катализатора:
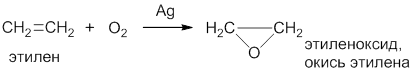
Гидроксилирование. Образование диолов
При взаимодействии алкена с холодным водным раствором перманганата калия образуются диолы (гликоли) ─ реакция Вагнера (проба Байера):
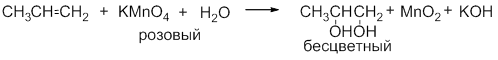
Гидроксилирование проводят при комнатной температуре в нейтральной или слабощелочной среде. Гидроксилирование алкенов - наиболее важный метод получения гликолей. Эту реакцию можно использовать для обнаружения непредельных соединений.
Гликоли – двухатомные спирты, в молекулах которых гидроксильные группы расположены у соседних атомов углерода.
Окисление в жестких условиях (с деструкцией углеродного скелета)
При действии концентрированных растворов окислителей (перманганат калия, хромовый ангидрид, хромовая кислота, азотная кислота) молекула алкена разрывается по месту двойной связи, образуя кетоны или кислоты:
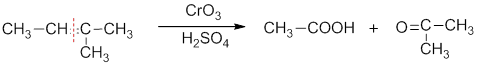
Концевая группа (═СН2) окисляется до (СО2), например:
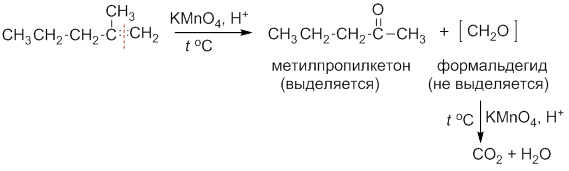
В этих условиях формальдегид окисляется далее до угольной кислоты, которая распадается на углекислый газ и воду.
Деструктивное окисление алкенов можно применять для определения их структуры.
Другие материалы по данной теме
Видео
Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и толуола)
