Химия
3.4. Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и толуола)
Ароматические углеводороды. Реакции электрофильного замещения
Аренами называют циклические углеводороды состава CnH2n-6, имеющие в составе ароматическую систему связей. Простейшим представителем ароматических углеводородов или аренов является бензол C6Н6.
Формула, отражающая строение молекулы бензола, была впервые предложена немецким химиком Кекуле (1865).
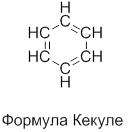
Объёмная и шаростержневая модели молекулы бензола
Механизм реакций электрофильного замещения
Этот тип реакций является наиболее характерным для ароматических углеводородов, так как при этом сохраняется ароматическая система бензольного кольца.
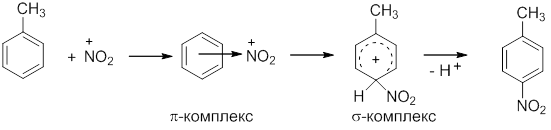
Все реакции электрофильного замещения (SE) протекают по сходному механизму и начинаются с атаки электрофильной частицы (Е+) на ароматическую p-электронную систему. Электрофильная частица притягивается ароматическим секстетом электронов и образует в равновесной стадии так называемый p-комплекс. В этом состоянии еще нет ковалентной связи между электрофилом и ядром, а кольцо еще не потеряло ароматический характер. Затем одна p-электронная пара кольца идет на образование ковалентной связи с электрофилом и образуется неароматический так называемый s-комплекс. Затем следует потеря протона с восстановлением ароматического цикла и образованием конечного продукта, в котором электрофильная частица заместила атом водорода:
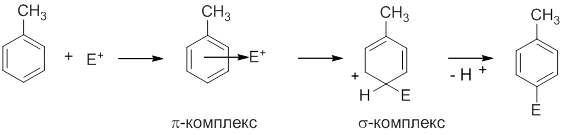
Рассмотрим некоторые реакции электрофильного замещения.
Нитрование
Бензол и концентрированная азотная кислота очень медленно реагируют с образованием нитробензола. Скорость взаимодействия значительно увеличивается при добавлении концентрированной серной кислоты; поэтому нитрование ароматических соединений часто проводят смесью концентрированных азотной и серной кислот (соотношение 1:2), называемой нитрующей смесью. При нитровании толуола образуется смесь двух изомерных продуктов:
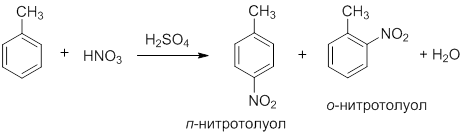
Механизм реакции SE:
1. Образование электрофила:
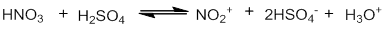
2. Взаимодействие электрофила с бензольным кольцом:
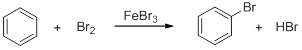
Галогенирование
Ароматические углеводороды вступают в реакцию с хлором или бромом с образованием соответствующих галогенопроизводных только в присутствии катализаторов – безводных галогенидов железа, алюминия или цинка, называемых кислотами Льюиса:
Роль кислоты Льюиса в данном случае состоит в том, что бром (или хлор), выступая основанием, отдает электронную пару одного из атомов галогениду алюминия. В результате происходит сильная поляризация связи Br-Br и один из его атомов становится достаточно электрофильным, вступая в кислотно-основное взаимодействие с молекулой брома (или хлора):
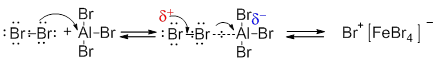
Образующийся комплекс и выступает как электрофильный бромирующий агент по отношению к аренам, действуя по описанному уже механизму SE.
Другие материалы по данной теме
Видео
Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и толуола)
