Химия
3.4. Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и толуола)
Алкены. Реакции электрофильного присоединения
Алкены – это непредельные углеводороды, в молекулах которых есть одна двойная( С=С) углерод-углеродная связь. Алкены называют олефинами или этиленовыми углеводородами. К непредельным углеводородам относят соединения, содержащие в углеродной цепи одну или несколько кратных (двойных или тройных) углерод-углеродных связей.
Химия алкенов - это, прежде всего, химия углерод-углеродной связи. Двойная связь состоит из прочной s-связи и менее прочной p-связи. Поэтому типичными реакциями олефинов будут реакции, при которых происходит разрыв p-связи, т.е. реакции присоединения:
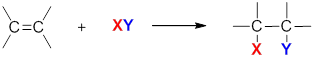
Какие реагенты могут присоединяться к С═С связи? Вследствие удаленности p-электроны в меньшей степени удерживаются ядрами атомов углерода. Эти электроны особенно доступны для реагентов с недостатком электронов (т.е. электрофилов и свободных радикалов). Таким образом, двойная связь С═С- связь служит донором электронов, т.е. ведет себя как основание.
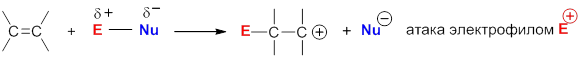
Механизм электрофильного присоединения к алкенам
Многие реакции присоединения к алкенам начинаются с атаки катионом или положительно заряженным концом поляризованной молекулы p-электронов двойной связи, после чего следует атака нуклеофилом образовавшегося карбокатиона:
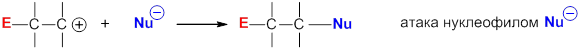
Присоединение галогенов
Алкены легко реагируют с растворами Br2 или Cl2 (I2 значительно менее активен) в инертном растворителе, например, ССl4, образуя вицинальные дигалогениды:
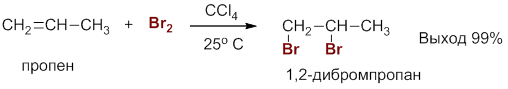
Присоединение галогена происходит быстро при комнатной температуре и не требует облучения УФ-светом. Эта реакция проходит с высоким выходом и является лучшим методом получения вицинальных дигалогенидов (вицинальные дигалогениды – это молекулы, в которых галогены связаны с соседними атомами углерода).
Присоединение галогеноводородов
Алкены реагируют с хлористым, бромистым или иодистым водородом с образованием соответствующих алкилгалогенидов:
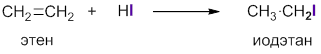
Реакцию обычно проводят, пропуская газообразный галогеноводород непосредственно в алкен. Присоединение галогеноводородов к несимметричным олефинам происходит в соответствии с правилом В.В.Марковникова (1896 г.): при ионном присоединении кислоты к двойной углерод-углеродной связи алкена, водород присоединяется к атому углерода, который имеет большее число атомов водорода (который более гидрогенизирован):
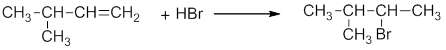
Такое направление присоединения можно объяснить, исходя из механизма электрофильного присоединения галогеноводородов (механизм AE или AdE). При взаимодействии пропилена с бромоводородом возможно образование двух карбокатионов:
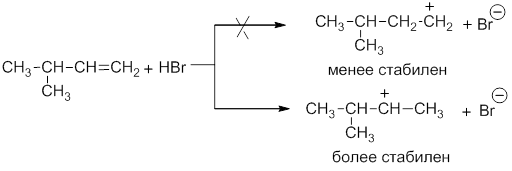
Изопропил-катион более стабилен, чем пропил-катион, благодаря положительному индукционному эффекту двух метильных групп. Далее более устойчивый катион (более долгоживущий) присоединяет анион галогена:
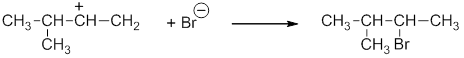
Более точно правило Марковникова можно сформулировать так: присоединение протона к алкену происходит с образованием наиболее стабильного карбокатиона.
Гидратация алкенов
Взаимодействие алкена с разбавленным водным раствором кислоты называется реакцией гидратации. Продуктом реакции является спирт. Присоединение протекает по правилу Марковникова:
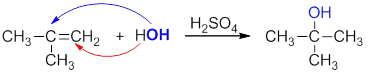
Механизм реакции присоединения воды к алкену аналогичен присоединению галогеноводородов. Поскольку вода не относится к электрофильным реагентам, реакция протекает только при наличии катализаторов – неорганических кислот: серной или фосфорной. При диссоциации кислоты образуется протон, который играет роль электрофила и присоединяется к молекуле алкена с образованием более стабильного карбокатиона.
Другие материалы по данной теме
Видео
Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и толуола)
