Химия
3.5. Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола
Окисление спиртов
Первичные спирты можно окислить до альдегидов (RCHO) нагреванием с металлической медью или оксидом меди (II) при высокой температуре. Двойная углерод–кислородная связь образуется в результате элиминирования двух атомов водорода в виде молекулы Н2, поэтому процесс называется дегидрированием. Реакцию проводят, пропуская пары спирта через нагретую до 200–300 оС трубку с медными стружками. Альдегид и непрореагировавший спирт конденсируют и разделяют перегонкой:
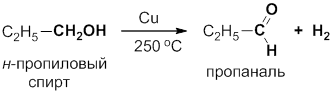
В качестве катализаторов дегидрирования можно использовать и другие металлы, например платину и палладий.
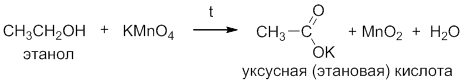
Первичные спирты можно окислить до карбоновых кислот (RCOOH) нагреванием с водным раствором KMnO4 или хромовой кислоты. После окончания реакции водный раствор калиевой соли карбоновой кислоты отфильтровывают от MnO2 и кислоту выделяют добавлением более сильной минеральной кислоты.
Вторичные спирты окисляются до кетонов R2CO действием перманганата калия или хромовой кислоты. Их также можно дегидрировать медью:
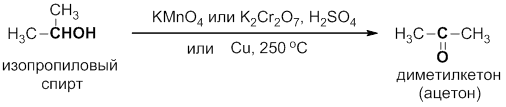
Третичные спирты не окисляются в щелочной среде, а в присутствии кислот они быстро дегидратируются до алкенов, последние окисляются с деструкцией углеродного скелета.
Реакцию окисления можно использовать для качественного обнаружения спиртов. Так первичные и вторичные спирты можно отличить практически от любого класса соединений по их окислению CrO3 в водном растворе серной кислоты – в течение 2 секунд прозрачный оранжевый раствор становится голубовато-зеленым и мутнеет. Третичные спирты не дают этой реакции.
Горение спиртов также является реакцией окисления. Спирты горят на воздухе бледно-голубым пламенем с образованием углекислого газа и воды. Реакция экзотермична, при сгорании 1 моль спирта выделяется 1370 кДж/моль тепла.
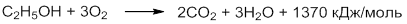
Другие материалы по данной теме
Видео
Особенности свойств многоатомных спиртов и фенолов
