Химия
2.3. Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния
Фосфор
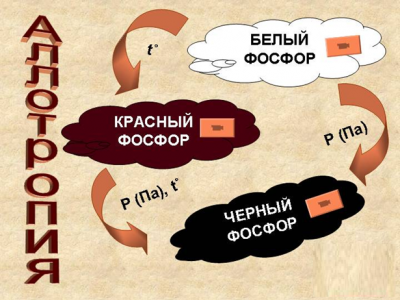
Белый фосфор - мягкое воскообразное вещество, состоящее из тетраэдрических молекул Р4. Он плавится при 44оС, кипит при 257оС. При 800оС начинается диссоциация четырехатомных молекул на двухатомные Р2, а при 1200оС - на атомы. Белый фосфор - реакционноспособное вещество. На воздухе при комнатной температуре он окисляется до Р4О10, а при 40оС происходит самовоспламенение и бурное горение фосфора:
Р4 + 5О2 = Р4О10
Самовоспламенение белого фосфора

Изучение окисления белого фосфора привело к открытию цепных реакций Н.Н.Семеновым - российским физико-химиком, лауреатом Нобелевской премии.

Фосфор также горит в среде галогенов, диоксида азота и СО2, окисляется азотной и концентрированной серной кислотами до Н3РО4:
Р4 + 10Сl2 = 4РCl5 2P4 + 10NO2 = 2P4O10 + 5N2
P4 + 10CO2 = P4O10 + CO
3P4 + 20HNO3 + 8H2O = 12H3PO4 + 20NO
При нагревании в растворах щелочей белый фосфор диспропорционирует:
Р4 + 3КОН + 3Н2О = РН3 \( \uparrow\) + 3КН2РО2
Белый фосфор и, особенно, его пары очень ядовит.
Существуют другие модификации фосфора. Красный фосфор образуется при нагревании белого фосфора без доступа воздуха до 300oC. Красный фосфор не ядовит, на воздухе воспламеняется при 240оС.
Черный фосфор образуется при нагревании белого под большим давлением. Он наименее активен, не ядовит, по внешнему виду и свойствам напоминает графит.
Другие материалы по данной теме
Видео
9.18. Фосфор